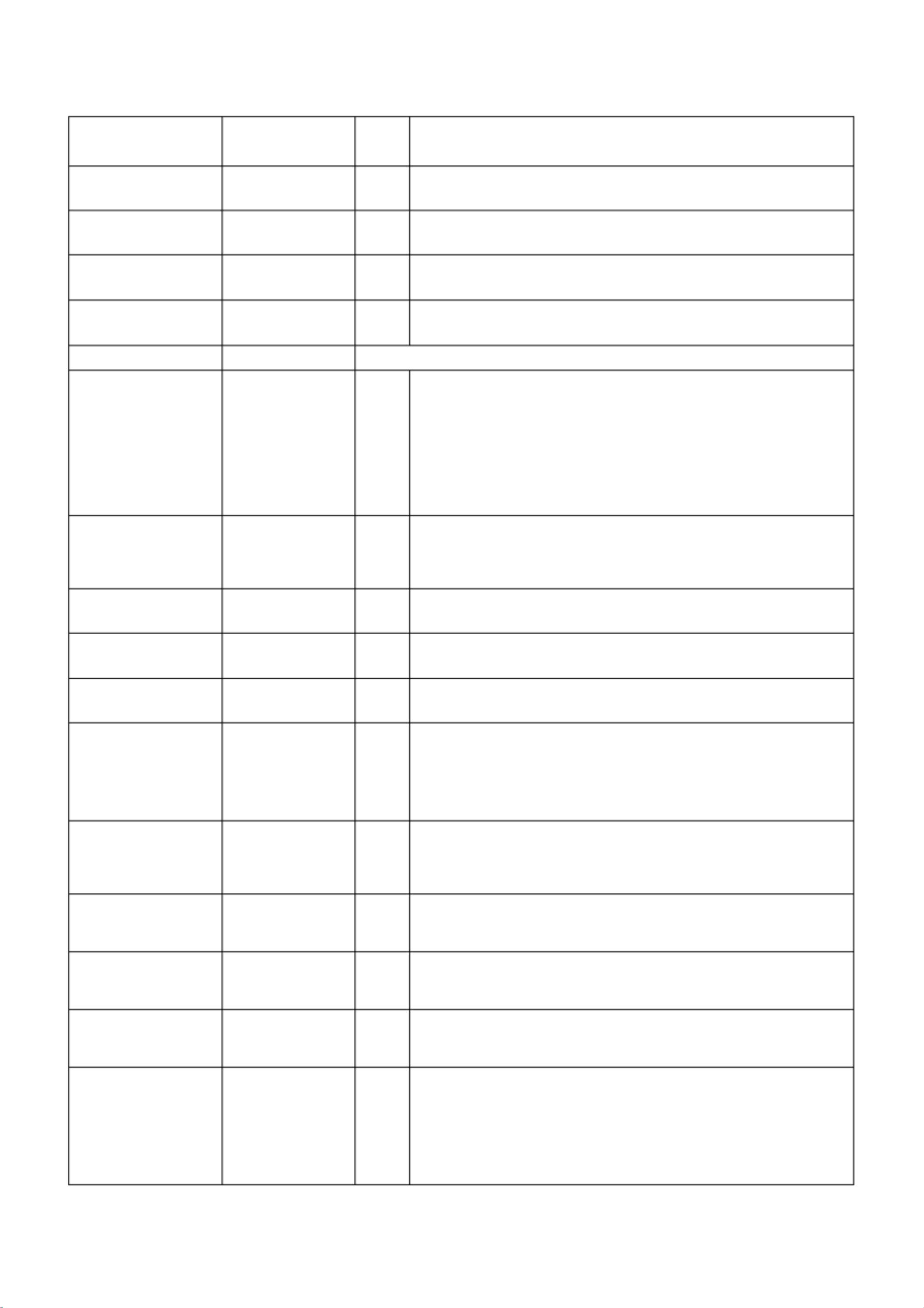
境内医疗器械主文档登记更新电子资料要求
版权申诉
127 浏览量
更新于2024-07-05
收藏 409KB PDF 举报
该文件是关于境内医疗器械主文档登记及更新资料的电子目录,主要针对行业内的企业进行产品注册和管理。目录详细列出了不同章节下所需提交的资料及其要求,涉及质量管理、符合性声明、非临床研究等多个方面。
详细说明:
1. 地区性管理信息:这是提交资料的第一部分,包括申报资料目录、申请表和质量管理等相关文件。境内主文档所有者需提交营业执照复印件,更新时需提供原登记回执。同时,企业需要出具真实性声明,并在有应用史的情况下提供注册证或境外上市证明。
2. 综述资料:这一章要求提交包含目录的综述资料,器械描述需全面,包括操作原理。虽然器械描述下的子标题无内容,但实际提交时需要涵盖产品的基本信息。
3. 非临床研究资料:这部分资料主要包括标准和非临床研究的相关信息。企业需列出涉及的所有标准,并提供符合性声明和/或认证。此外,还需要提交物理和机械性能等非临床研究的数据,确保产品安全性。
该文件与【标签】中的"行业报告"、"机械制造"、"产业"、"云计算"、"智慧医疗"相关,但主要集中在医疗器械行业的规范操作上,尤其是对产品质量管理和注册流程的严谨要求。对于从事医疗器械生产和销售的企业,遵循这份目录能够确保按照国家规定提交完整、准确的注册资料,从而顺利进行产品备案和市场准入。同时,这也体现了监管机构对医疗器械安全性和有效性的重视,以及推动行业标准化和信息化发展的趋势。在智慧医疗领域,这样的规范化管理更是必不可少,因为这直接影响到医疗设备的数据安全和临床效果。
_webkit
- 粉丝: 30
- 资源: 1万+
最新资源
- 掌握Jive for Android SDK:示例应用的使用指南
- Python中的贝叶斯建模与概率编程指南
- 自动化NBA球员统计分析与电子邮件报告工具
- 下载安卓购物经理带源代码完整项目
- 图片压缩包中的内容解密
- C++基础教程视频-数据类型与运算符详解
- 探索Java中的曼德布罗图形绘制
- VTK9.3.0 64位SDK包发布,图像处理开发利器
- 自导向运载平台的行业设计方案解读
- 自定义 Datadog 代理检查:Python 实现与应用
- 基于Python实现的商品推荐系统源码与项目说明
- PMing繁体版字体下载,设计师必备素材
- 软件工程餐厅项目存储库:Java语言实践
- 康佳LED55R6000U电视机固件升级指南
- Sublime Text状态栏插件:ShowOpenFiles功能详解
- 一站式部署thinksns社交系统,小白轻松上手