医疗器械产品设计开发流程详解
版权申诉
69 浏览量
更新于2024-07-02
收藏 1.31MB PDF 举报
"该文档详细阐述了医疗器械产品的设计与开发过程,涵盖了设计和开发的概念、一般过程、输入和输出的要素以及设计评审的重要性。"
在医疗器械产品的设计与开发过程中,设计是一个将计划、创意和设想转化为视觉表达的过程,而开发则涉及到新产品的创造性研制、改良或仿制,涵盖了一系列发明、组合、增减和革新的活动。
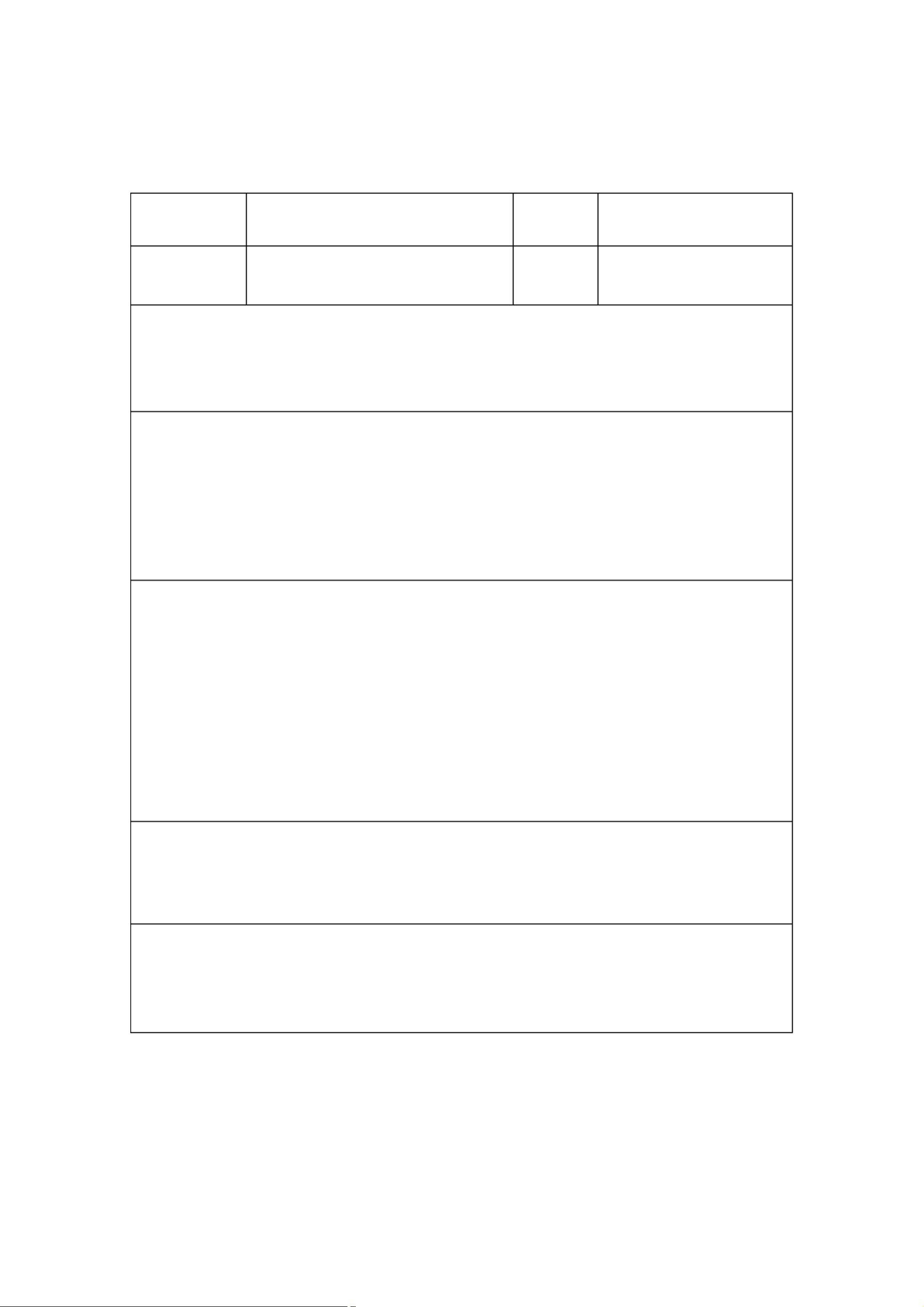
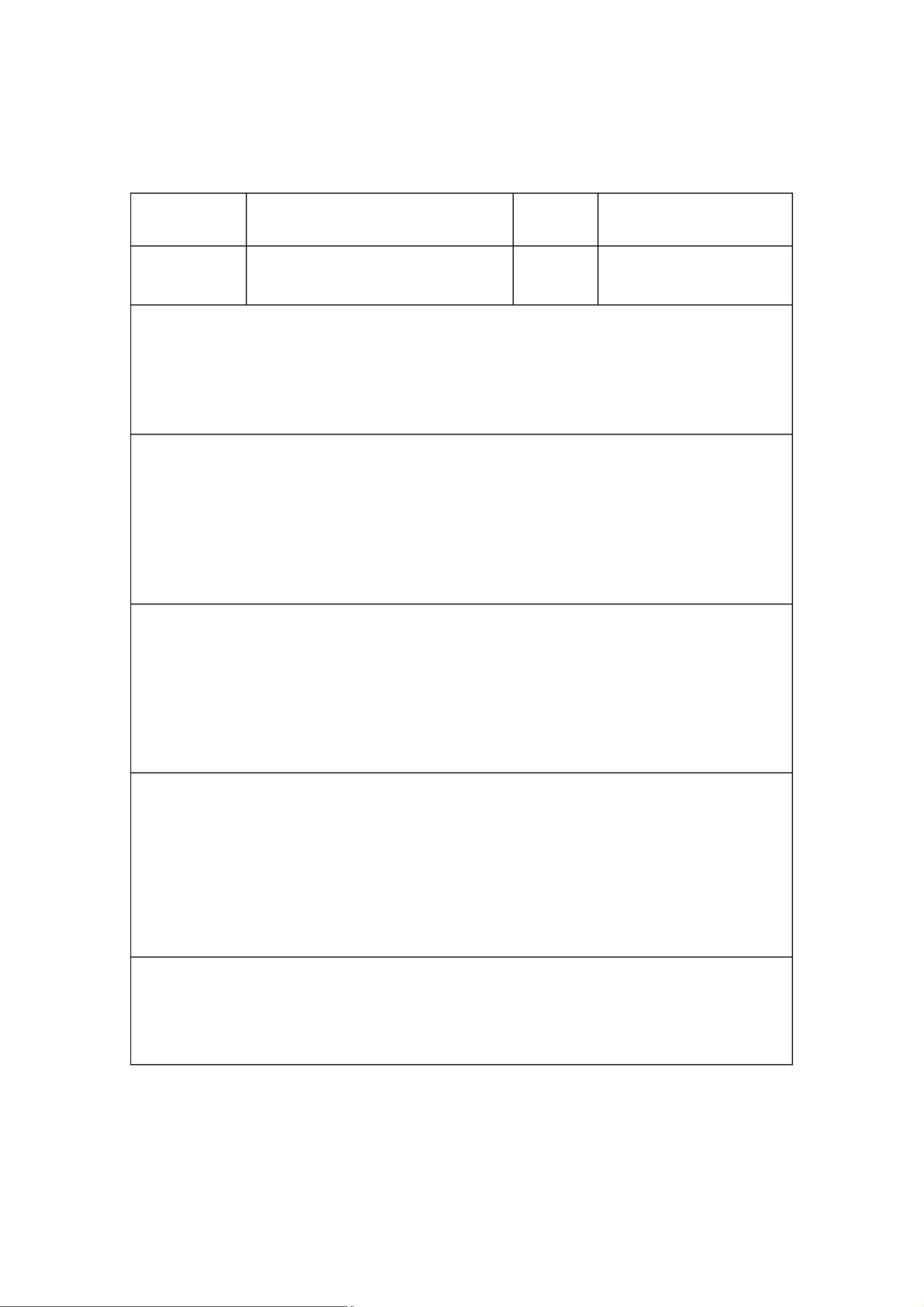
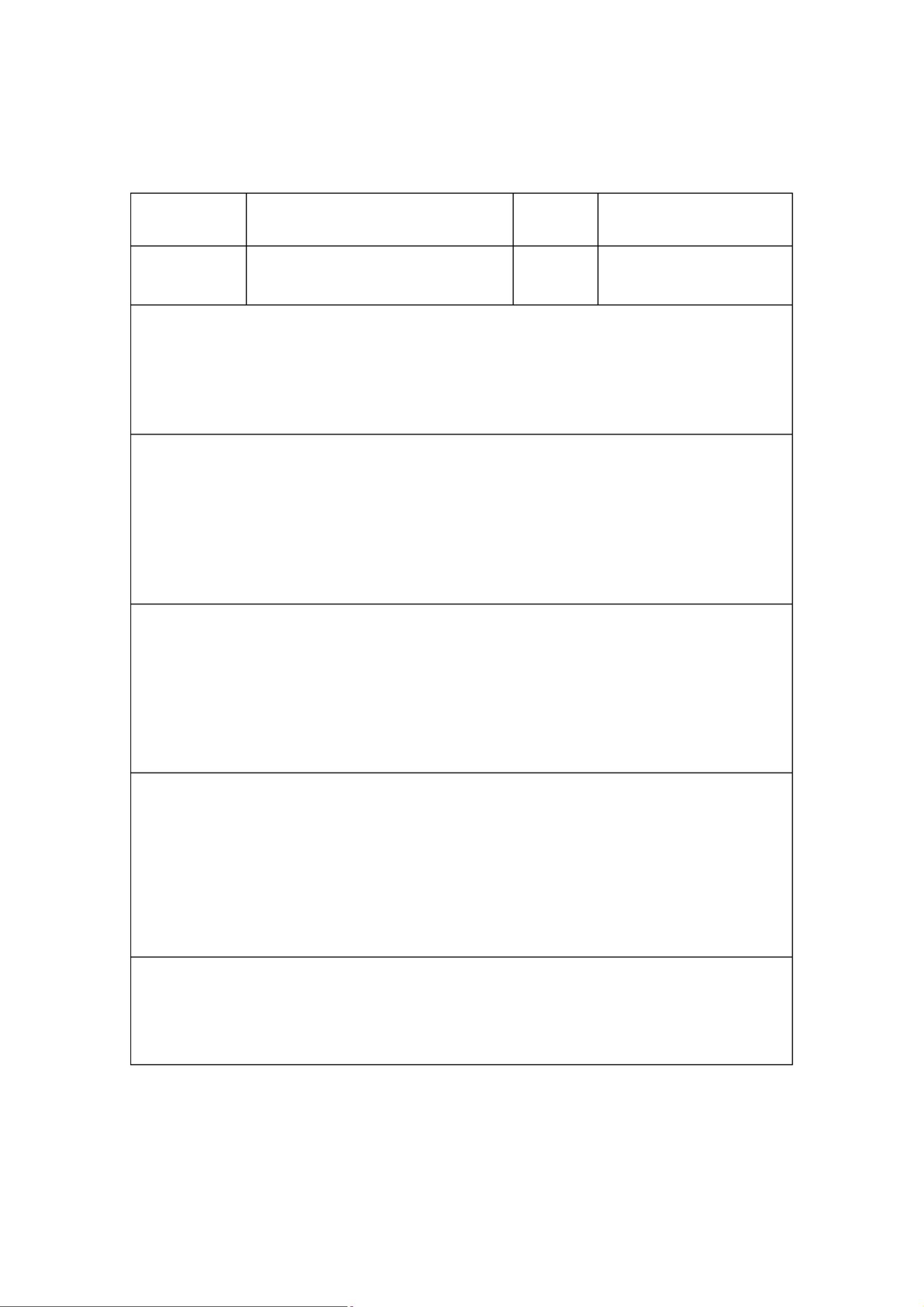
设计和开发的一般流程分为多个步骤。首先,需要策划设计和开发,建立相应的程序,组建专门的团队,并提出初步设想。接下来,设计和开发的输入阶段至关重要,其中包括明确产品的功能、性能和安全要求,了解相关的法律、法规,收集同类产品信息,以及执行风险管理。输入的内容需形成文件,涉及预期用途、性能、使用者需求、安全性、生物相容性、电磁兼容性等多个方面。
设计和开发的输出则应满足输入的所有要求,包括技术要求、生产工艺、产品图纸、标准、环境要求、检验程序、包装、追溯标记、样品或样机、安装及使用手册,以及设计和开发的完整记录。这些输出是确保产品质量和合规性的关键。
设计和开发的评审是一个评估设计结果是否符合预期目标和法规要求的系统活动。评审内容包括但不限于:确认设计是否满足所有规定要求,输入是否满足设计和开发的需求,产品性能的生命周期数据是否科学,设计能力是否充足,对环境的影响,以及所选材料是否合适。通过评审,可以及时发现并解决潜在问题,防止产品不合格。
在互联网和计算机科学(cs)领域,医疗器械产品的设计与开发同样受到数字化和技术进步的影响,例如,可能涉及软件集成、数据分析、远程监控等方面,使得产品的创新性和功能性更为强大。理解这一过程对于医疗设备制造商、软件开发者以及相关监管机构都至关重要,以确保产品的安全、有效和合规。
2021-10-14 上传
2021-10-14 上传
2023-07-22 上传
2023-05-14 上传
2023-05-16 上传
2024-01-25 上传
2023-10-23 上传
2023-06-22 上传
2023-11-07 上传
xxpr_ybgg
- 粉丝: 6715
- 资源: 3万+
最新资源
- zlib-1.2.12压缩包解析与技术要点
- 微信小程序滑动选项卡源码模版发布
- Unity虚拟人物唇同步插件Oculus Lipsync介绍
- Nginx 1.18.0版本WinSW自动安装与管理指南
- Java Swing和JDBC实现的ATM系统源码解析
- 掌握Spark Streaming与Maven集成的分布式大数据处理
- 深入学习推荐系统:教程、案例与项目实践
- Web开发者必备的取色工具软件介绍
- C语言实现李春葆数据结构实验程序
- 超市管理系统开发:asp+SQL Server 2005实战
- Redis伪集群搭建教程与实践
- 掌握网络活动细节:Wireshark v3.6.3网络嗅探工具详解
- 全面掌握美赛:建模、分析与编程实现教程
- Java图书馆系统完整项目源码及SQL文件解析
- PCtoLCD2002软件:高效图片和字符取模转换
- Java开发的体育赛事在线购票系统源码分析