使用e-CTD4.0自动化定义临床数据(SDTM)样例
下载需积分: 23 | PDF格式 | 283KB |
更新于2024-06-27
| 81 浏览量 | 举报
本文主要介绍的是e-CTD4.0规范下的数据定义样例,特别是在临床研究领域如何按照国际协调组织(ICH)的标准,利用SDTM(Standard for the Exchange of Nonclinical Data)来定义和组织临床数据。描述中提到了自动化工具的应用,通过点击鼠标自动生成xlsx文件,并且可以查询相关标准,如不良反应和数据集,最终由计算机辅助完成复杂的数据定义工作。
临床研究中,数据定义是非常关键的一环,确保数据的标准化、一致性和可比性。e-CTD(Electronic Common Technical Document)4.0是提交临床试验数据的标准格式,它促进了跨国间的药品审评和注册流程的一致性。在e-CTD4.0中,数据定义的重要性更加突出,因为它要求所有提交的数据必须有清晰的元数据描述。
SDTM是CDISC(Clinical Data Interchange Standards Consortium)提出的一种数据模型,用于结构化非临床研究数据,但在临床研究中也被广泛应用。SDTM旨在提供一个标准化的方式来组织和表示临床试验中的各种观察结果,如患者基线特征、疗效指标和不良事件等。通过SDTM,不同研究之间的数据可以直接比较,提高了数据分析的效率和质量。
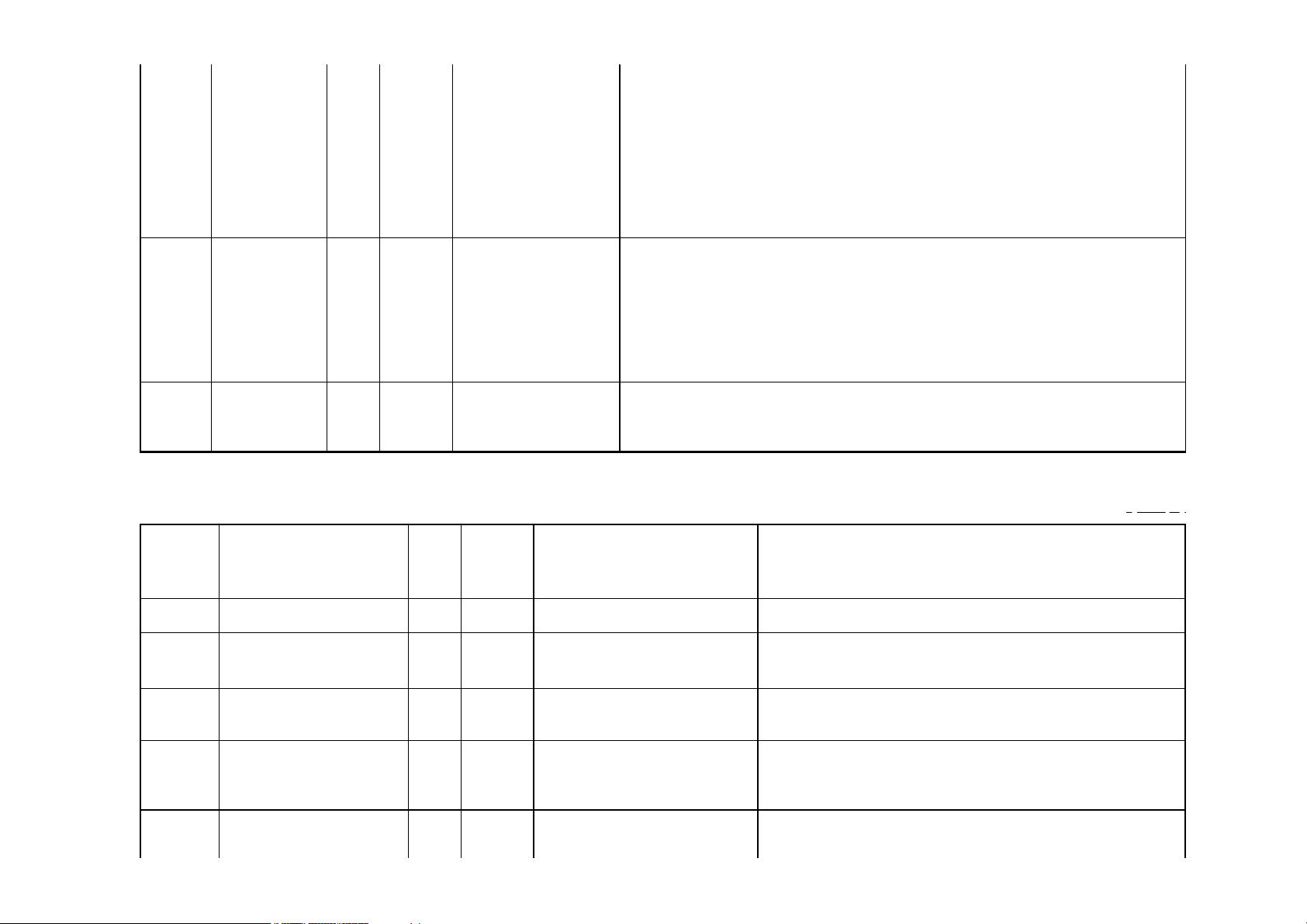
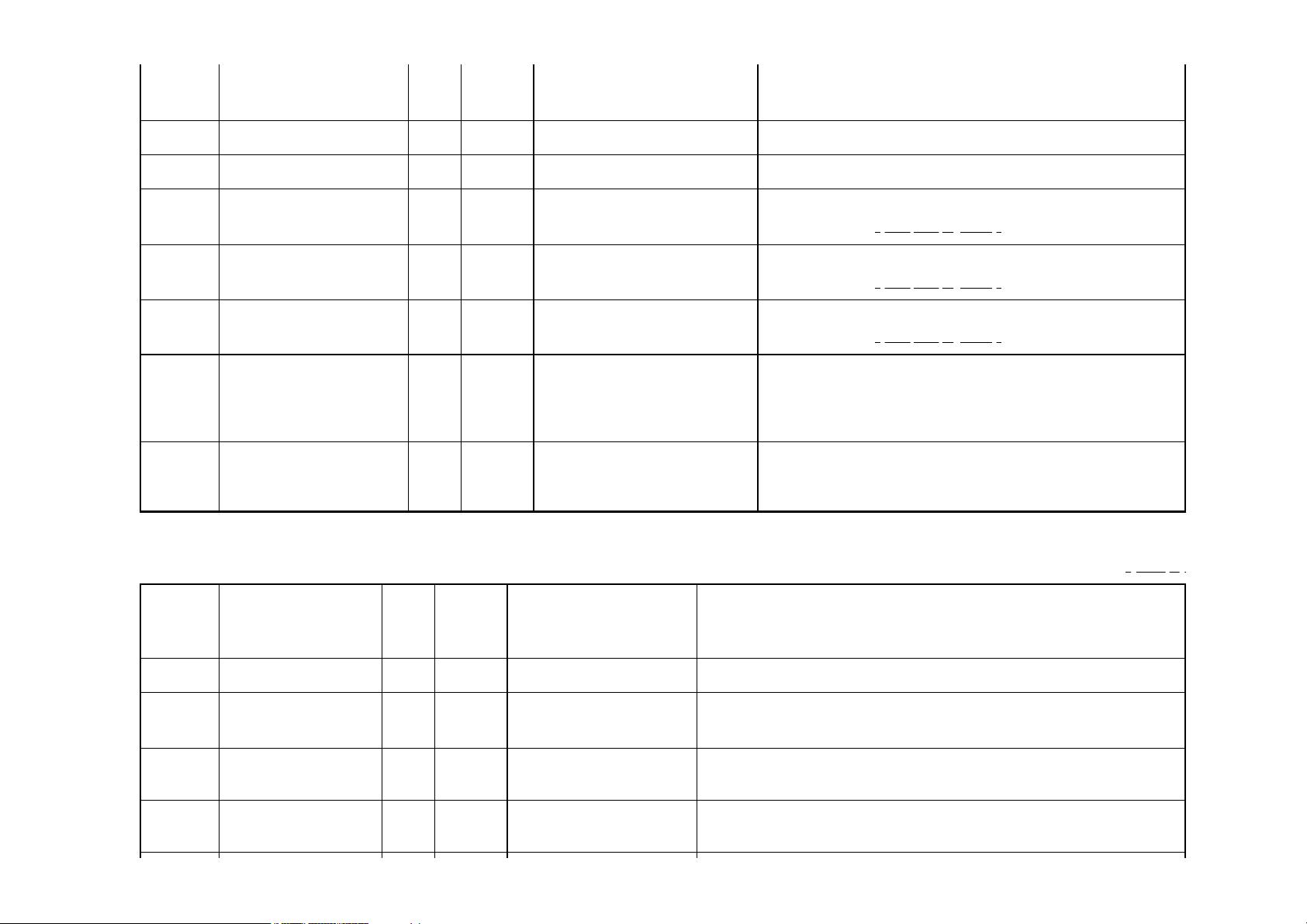
文件中提到的CDISC01_1:SDTMIG3.1.2可能是指SDTM实施指南的版本,这是CDISC制定的一套详细指导原则,用于解释如何将原始临床数据转化为SDTM格式。"StudyName"、"StudyDescription"、"ProtocolName"、"MetadataName"和"MetadataDescription"等字段是定义XML文档中的关键元素,它们分别代表了研究名称、研究描述、方案名称、元数据名称和元数据描述,这些都是构建数据定义的重要组成部分。
"Date/Time of Define-XML document generation"记录了定义XML文件的生成时间,而"Define-XML version"指定了使用的Define-XML规范版本,这里是2.1.0。"Stylesheet version"则指明了样式表的版本,用于呈现XML文件的视觉样式。此示例中的"CDISC01-1"可能是特定研究的标识符,"DataDefinitionsV-1"可能表示数据定义的版本号。
"StudyCDISC01_1, DataDefinitionsV-1"这部分描述了数据定义文件的内容,即针对CDISC01-01研究的SDTM数据集的定义。注意,这个元数据版本仅用于展示Define-XML2.1的新特性,而非提供全面的SDTM数据集包的所有元数据实例。此外,这个示例并非用于正式提交,而是用于演示目的,尽管它仍采用了非标准变量的准备方法。
这个资源提供了e-CTD4.0框架下SDTM数据定义的一个实例,展示了如何根据ICH和CDISC标准来组织临床研究数据,以及如何利用自动化工具提高数据定义的效率。对于从事临床研究数据管理、生物统计学和药品开发的专业人士来说,理解并掌握这些知识对于确保数据质量和合规性至关重要。
相关推荐









ddyca
- 粉丝: 1
最新资源
- 多功能字模信息获取工具应用详解
- ADV2FITS开源工具:视频帧转换为FITS格式
- Tropico 6内存读取工具:游戏数据提取与分析
- TcpUdp-v2.1:便捷网络端口管理小工具
- 专业笔记本BIOS刷新软件InsydeFlash 3.53汉化版
- GridView中加入全选复选框的客户端操作技巧
- 基于JAVA和ORACLE的网吧计费系统解决方案
- Linux环境下Vim插件vim-silicon:源代码图像化解决方案
- xhEditor:轻量级开源Web可视化HTML编辑器
- 全面掌握Excel技能的视频课程指南
- QDashBoard:基于QML的仪表盘开发教程
- 基于MATLAB的图片文字定位技术
- Proteus万年历仿真项目:附源代码与Proteus6.9SP4测试
- STM32 LED实验教程:点亮你的第一个LED灯
- 基于HTML的音乐推荐系统开发
- 全中文注释的轻量级Vim配置教程