【DNAMAN高级应用】:8个技巧优化PCR条件,减少非特异性扩增
发布时间: 2025-01-03 11:14:32 阅读量: 12 订阅数: 12 


DNAMAN分析软件
# 摘要
本文旨在介绍DNAman软件在PCR技术中的应用,并探讨优化PCR反应条件的理论基础与实验技巧。通过分析PCR的原理、关键要素、特异性影响因素,以及温度梯度、引物设计和模板质量的重要性,我们提出了一套理论策略来优化PCR条件。接着,本文展示了如何使用DNAman软件通过模拟实验进行PCR条件的优化,并讨论了如何分析PCR结果以微调参数。高级技巧部分详细介绍了减少非特异性扩增的方法,包括特殊模板处理、多引物PCR体系优化和PCR后处理技术。最后,通过成功案例分析与问题解决,本文展示了如何将这些策略应用于实际情境中,以解决PCR过程中遇到的问题。
# 关键字
DNAman软件;PCR技术;条件优化;非特异性扩增;引物设计;电泳分析
参考资源链接:[DNAMAN:引物与PCR分析的实用教程](https://wenku.csdn.net/doc/2km8nnndsh?spm=1055.2635.3001.10343)
# 1. DNAman软件的简介与PCR技术基础
DNAman软件是一款功能强大的分子生物学工具,用于设计PCR引物、模拟PCR反应和优化PCR条件。在深入讨论如何使用这一软件进行PCR实验的优化之前,让我们先了解PCR技术的基础知识。
**## 1.1 DNA的复制机制**
聚合酶链反应(PCR)是一种体外模拟DNA复制过程的技术,它能够在短时间内放大特定的DNA片段。PCR涉及三个关键步骤:变性、退火和延伸。在变性阶段,高温使得双链DNA解链成单链;退火阶段,引物与目标DNA的互补序列结合;延伸阶段,DNA聚合酶通过引物延伸合成新的DNA链。这一循环重复多次,目标DNA片段得到指数级的扩增。
**## 1.2 PCR反应的三步循环**
详细的PCR循环通常包括以下步骤:
1. 94-98°C下变性DNA约1-2分钟,使双链DNA解链。
2. 退火阶段温度下降至50-65°C,使引物与模板DNA结合,这个步骤通常持续20-40秒。
3. 延伸阶段,温度上升至72°C,DNA聚合酶在引物的引导下沿模板链合成新的DNA链,这一步骤持续时间取决于目标片段的长度,通常为1分钟/千碱基对。
了解这些基础知识后,将有助于深入理解PCR技术,从而更有效地利用DNAman软件进行实验设计和优化。
# 2. 优化PCR反应条件的理论基础
### 2.1 PCR反应的原理与关键要素
#### 2.1.1 DNA的复制机制
聚合酶链反应(Polymerase Chain Reaction, PCR)是一种快速复制特定DNA序列的技术,其基本原理类似于自然界中的DNA复制过程。在细胞中,DNA复制是在DNA聚合酶的催化作用下完成的,需要一条单链DNA作为模板。复制过程从一个DNA聚合酶的引物结合位点开始,通过添加核苷酸到引物的3'端来延长新的DNA链。
PCR反应在试管中模拟这一过程,使用人工合成的引物和DNA聚合酶(通常是耐高温的Taq聚合酶),在体外进行DNA的扩增。整个过程包括三个基本步骤:变性、退火、延伸,循环进行直至产生足够量的目标DNA片段。
#### 2.1.2 PCR反应的三步循环
PCR反应的三步循环为:
1. **变性(Denaturation)**:在高温下(通常94-98°C),双链DNA解链成单链模板。
2. **退火(Annealing)**:温度降低至引物与目标序列相匹配的特异性温度(通常50-65°C),引物与单链DNA模板结合。
3. **延伸(Extension)**:在适当的温度下(通常72°C),Taq聚合酶沿模板合成新的DNA链。
这三个步骤不断循环,目标DNA片段的数量理论上每一轮都会翻倍,从而实现快速扩增。
### 2.2 影响PCR特异性的主要因素
#### 2.2.1 酶的特异性与保真度
Taq聚合酶是PCR中常用的DNA聚合酶,它具有高温稳定性,但不具备3'到5'的外切酶活性,因此错误掺入的核苷酸不会被修正,导致较低的保真度。此外,酶的特异性决定了其在非特异性序列上的扩增倾向,即可能导致非特异性扩增产物的出现。
为了提高PCR的特异性和保真度,可以选择使用具有校对功能的聚合酶,或者添加一定比例的DMSO来降低PCR的非特异性扩增。
#### 2.2.2 引物设计原则与非特异性结合
引物设计是PCR实验中的关键步骤。引物的特异性决定了反应的特异性。引物设计应遵循以下原则:
- 引物长度一般为18-30个碱基。
- 引物的GC含量应接近50%。
- 引物之间避免产生互补区域。
- 引物不应与非目标序列高度相似。
为了减少非特异性结合,可以使用引物设计软件进行检测,并在实验中通过梯度PCR确定最佳的退火温度。
#### 2.2.3 模板质量和纯度对PCR的影响
模板DNA的质量直接影响PCR扩增的特异性和效率。高质量的模板应该具有较高的纯度和完整性。纯化步骤中可能引入的杂质如蛋白酶、离子或其他有机溶剂会抑制PCR反应。
纯化模板DNA时,推荐使用诸如酚-氯仿抽提或硅胶膜柱纯化等方法。在测序分析后,确保无外源性污染且目标DNA片段浓度适宜。
### 2.3 优化PCR条件的理论策略
#### 2.3.1 温度梯度和循环数的优化
温度梯度PCR是一种评估不同退火温度对特异性扩增影响的技术。通过设置一个温度范围,并在该范围内寻找引物的最佳退火温度,可以有效地减少非特异性扩增。
循环数的优化需要根据目标DNA片段的起始数量和PCR效率进行调整。较少的循环数可能无法达到足够的目标DNA扩增量,而过多的循环数会导致非特异性产物的累积。
#### 2.3.2 缓冲液组成和离子强度的影响
缓冲液的组成直接影响酶的活性和特异性。标准PCR反应缓冲液通常包含Tris-HCl、KCl、MgCl2等成分,这些成分的浓度会影响酶的活性及扩增特异性。
离子强度(主要是MgCl2的浓度)对PCR反应有着决定性的影响。Mg2+不仅是Taq聚合酶的活性离子,还影响引物的特异性结合。MgCl2浓度较高时,非特异性扩增的几率增加。
```markdown
|MgCl2浓度 (mM)|影响|
| --- | --- |
|1.5|可能限制酶的活性|
|2.0-3.0|理想的范围,适中的酶活性和特异性|
|>4.0|导致非特异性扩增|
```
### 2.3.3 实验数据的综合分析
在优化PCR反应条件时,收集实验数据并进行分析是至关重要的。通过比较不同条件下的PCR结果,可以确定最佳的退火温度、引物浓度和MgCl2浓度等参数。
```mermaid
graph TD;
A[开始PCR实验] --> B[确定变量参数];
B --> C[执行PCR反应];
C --> D[收集实验数据];
D --> E[分析扩增产物];
E --> F{是否有目标产物};
F -- 是 --> G[优化并确定条件];
F -- 否 --> H[调整参数并重复实验];
H --> C;
G --> I[完成条件优化];
```
收集到的PCR产物通过琼脂糖凝胶电泳进行分析,目标产物应呈现出单一而明亮的条带。如果出现非特异性条带或无条带,则需要对实验参数进行调整并重新进行PCR反应。通过这样的迭代过程,最终可以找到最优化的PCR反应条件。
# 3. 使用DNAman软件进行PCR条件优化
在本章节中,我们将深入探讨如何使用先进的DNAman软件来优化PCR条件。DNAman作为一个功能强大的计算机辅助设计工具,其在设计PCR引物、模拟反应条件及分析实验结果方面展现了显著优势。本章节将详细介绍软件界面功能、模拟实验操作和结果分析策略。
## 3.1 DNAman软件界面与功能简介
### 3.1.1 软件操作流程与界面布局
DNAman软件界面设计简洁直观,操作流程顺滑,即使是初次使用也能迅速上手。软件的主要功能区域可以划分为以下几个部分:
- **项目管理区域**:在这里,用户可以创建新项目、打开已有项目、保存及导出项目数据。
- **序列编辑区域**:用户可以输入或粘贴DNA序列,进行编辑和注释。
- **引物设计区域**:该区域包含引物设计工具和引物分析工具,用户可以在此完成引物设计并获取引物特异性分析。
- **模拟实验区域**:用户可在此区域设置PCR模拟实验参数,包括温度梯度、引物浓度、离子强度等。
接下来,我们详细探讨如何使用DNAman进行引物设计以及分析其特异性。
### 3.1.2 设计引物与分析引物特异性
在设计引物时,DNAman软件提供了包括退火温度、GC含量、二聚体形成等在内的多种设计参数选择。以下是引物设计的简要步骤:
1. 在序列编辑区域输入或粘贴目标DNA序列。
2. 点击“引物设计”按钮,进入引物设计工具。
3. 设置引物长度、退火温度、GC含量等参数,然后开始设计。
4. 设计完成后,软件将提供多个候选引物方案。
5. 选择合适方案,点击“分析引物特异性”进行进一步分析。
引物特异性分析能够评估引物与非目标序列的互补性,降低非特异性扩增的风险。分析结果通常以表格形式呈现,包括每个引物与目标序列的匹配情况及可能的非特异性结合区域。
在进行引物设计和特异性分析时,用户需要注意以下关键点:
- **退火温度**:过高可能导致引物与模板结合不良,过低则会增加非特异性扩增的风险。
- **GC含量**:适中的GC含量有助于提高引物的特异性和退火温度。
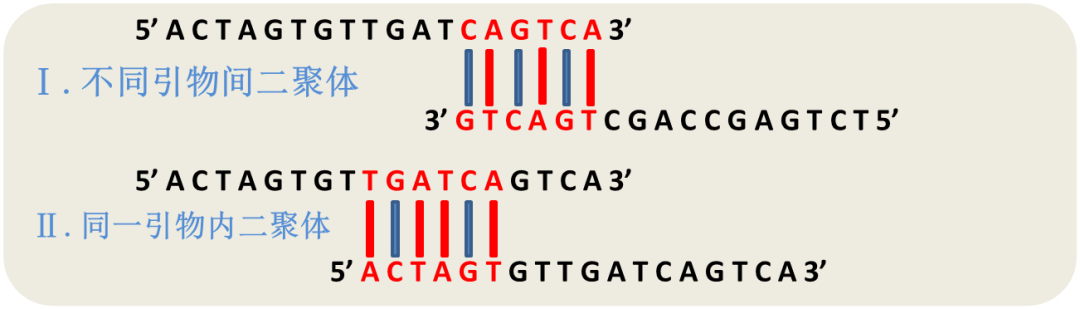
- **避免二聚体**:二聚体可能会降低PCR效率,应尽量设计引物避免二聚体形成。
## 3.2 通过模拟实验优化PCR条件
### 3.2.1 温度梯度模拟与最佳退火温度的选择
PCR反应中退火温度的选择是影响反应特异性的关键因素之一。DNAman软件提供的温度梯度模拟功能,可以帮助用户确定最佳退火温度。具体操作步骤如下:
1. 在模拟实验区域选择“温度梯度模拟”功能。
2. 设置温度梯度范围,一般从50℃至65℃。
3. 运行模拟,软件会模拟不同退火温度下的扩增效率。
4. 查看模拟结果,选择最合适的退火温度。
温度梯度模拟的结果通常以图表形式展现,不同的退火温度会对应不同的扩增效率,用户可以根据图表选择最佳退火温度。
### 3.2.2 引物浓度与离子强度调整模拟
引物浓度和PCR反应缓冲液中的离子强度都会对PCR特异性产生影响。通过DNAman软件模拟这些参数的调整,可以帮助用户找到最佳的实验条件。
1. 在模拟实验区域选择“引物浓度与离子强度调整模拟”功能。
2. 设置不同的引物浓度和离子强度值。
3. 运行模拟并查看结果,分析不同条件下的扩增效率。
4. 根据结果调整引物浓度和离子强度,以达到最佳的PCR反应条件。
调整模拟结果通常以曲线图或表格形式展现,方便用户进行直观的分析。
## 3.3 分析PCR结果并进行参数微调
### 3.3.1 PCR产物分析与电泳结果解读
PCR产物分析是评估PCR反应成功与否的重要步骤。通过电泳分析,用户可以观察到产物条带的大小和亮度,从而判断反应的特异性和效率。DNAman软件能够模拟电泳结果,帮助用户进行实验结果的解读。
1. 在软件中导入或模拟PCR产物数据。
2. 使用“PCR产物分析”功能。
3. 软件将根据设定的电泳条件模拟电泳图谱。
4. 分析电泳图谱,比对目标片段的大小,并判断扩增特异性和效率。
在进行电泳结果分析时,用户应注意以下几点:
- 目标条带的大小是否与预期相符。
- 是否出现非特异性条带。
- 条带的亮度是否足够,反映PCR产物的浓度。
### 3.3.2 循环数和延伸时间的微调策略
在PCR反应中,循环数和延伸时间对产物的特异性和产率有显著影响。DNAman软件同样提供了对这两项参数进行微调的模拟工具。
1. 运行基础PCR模拟。
2. 观察模拟结果,评估产物特异性及产率。
3. 根据需要,适当调整循环数和延伸时间。
4. 重新运行模拟,观察调整后的结果。
微调模拟结果同样以图表形式展现,用户可以直观地看到不同循环数和延伸时间设置对PCR结果的影响。
在本章节中,我们详细探讨了DNAman软件在PCR条件优化中的应用。软件的各项功能极大地简化了实验设计和优化流程,使研究者能够以高效率和高准确度地进行PCR实验。通过对软件界面功能的了解、模拟实验的操作以及结果的分析,研究者可以快速找到最适宜的PCR条件。下文将深入探讨减少非特异性扩增的高级技巧,使PCR实验达到更高水平的精准度。
# 4. 高级技巧减少非特异性扩增的实验应用
在PCR实验中,非特异性扩增是常见的问题,可能导致产生错误的扩增产物,从而影响实验结果的准确性。本章节将详细探讨如何通过高级技巧来减少非特异性扩增,包括特殊模板处理技术、多引物PCR体系优化和PCR后处理方法。
## 4.1 特殊模板处理技术
### 4.1.1 高GC含量模板的预处理方法
高GC含量的模板DNA在PCR过程中容易形成稳定的二级结构,这会干扰引物的结合和DNA聚合酶的活性,从而降低PCR的特异性。为了克服这个问题,可以采取以下几种预处理技术:
1. **使用特殊的PCR添加剂:** 添加一些特殊的化学试剂如二甲基亚砜(DMSO)、甘油或变性剂,可以减少DNA模板的二级结构形成,提高PCR反应的特异性。
2. **优化退火温度:** 通过升高退火温度,可以减少非特异性引物的结合,同时有利于特异性引物的结合。
3. **酶的选择:** 使用能够耐受较高温度的热稳定DNA聚合酶,如KOD或Phusion等,这些酶在高温下仍能保持活性,有助于减少非特异性扩增。
4. **模板DNA的稀释:** 稀释模板DNA可以降低模板的浓度,减少DNA分子之间相互作用的机会,从而减少非特异性扩增产物的形成。
下面是一个示例代码,展示如何设置PCR反应体系以处理高GC含量的模板:
```plaintext
PCR Reaction Mix (25 μL total volume):
10X PCR Buffer (with Mg2+): 2.5 μL
dNTPs (10 mM each): 0.5 μL
Template DNA: 10 ng - 100 ng
Forward Primer (10 μM): 1 μL
Reverse Primer (10 μM): 1 μL
DMSO: 1 μL (final concentration 4%)
Hot Start DNA Polymerase: 1 U
Sterile Water: Adjust to 25 μL
```
### 4.1.2 长片段PCR的优化策略
PCR扩增长片段DNA时,随着DNA长度的增加,非特异性扩增的可能性也相应增加。为了有效扩增长片段DNA,需要优化PCR条件,使用适当的策略:
1. **采用长距离PCR酶:** 使用专为长片段PCR设计的高保真酶,如Pfu DNA聚合酶或Phusion DNA聚合酶,这些酶在扩增长片段时具有更高的保真度和效率。
2. **增加延伸时间:** 对于长片段DNA,适当的延伸时间至关重要。根据片段长度,适当延长每个循环的延伸时间,以确保DNA聚合酶有足够的时间完成模板复制。
3. **循环数的优化:** 对于长片段扩增,可能需要增加PCR循环数以提高产物的产量,但过多的循环数会增加非特异性扩增的风险,因此需要仔细平衡。
下面是一个示例表格,展示如何为不同长度的DNA片段优化延伸时间:
| DNA片段长度 | 延伸时间(每个循环) |
|-------------|---------------------|
| 1 - 2 kb | 30 seconds |
| 2 - 3 kb | 45 seconds |
| 3 - 5 kb | 60 seconds |
| > 5 kb | 90 seconds |
## 4.2 多引物PCR体系优化
### 4.2.1 多重PCR原理与设计要点
多重PCR是指在同一PCR反应中使用多对引物同时扩增两个或多个目标序列。这种技术需要精心设计引物以避免引物之间的相互作用和非特异性扩增。多重PCR的原理和设计要点如下:
1. **引物特异性的设计:** 设计引物时要确保不同引物的特异性,包括避免引物间的互补性,这可能引起引物二聚体的形成。
2. **反应条件的优化:** 在多重PCR中,需要特别注意盐浓度、酶用量和退火温度等参数的调整。
3. **引物浓度的调整:** 不同引物的浓度需要精心平衡,以确保所有目标序列都能有效扩增。
4. **引物长度和GC含量的考量:** 引物的长度和GC含量应尽量一致,以保证扩增效率。
### 4.2.2 引物间的相互作用分析与控制
在多重PCR中,引物间的相互作用是一个关键问题。为了避免非特异性扩增,以下步骤可以帮助控制引物间的相互作用:
1. **热启动PCR酶的使用:** 热启动酶可以减少引物二聚体的形成,因为它们只有在温度升高到一定阈值之后才能被激活。
2. **使用引物阻断剂:** 某些情况下,可以添加一些特殊的分子来阻断引物的非特异性结合。
3. **使用高保真PCR酶:** 这种酶具有更高的校对活性,可以减少错误扩增的可能性。
4. **引物浓度的梯度实验:** 通过调整每个引物的浓度,找到最佳浓度比例,以确保所有目标片段均能特异性扩增。
## 4.3 PCR后处理方法
### 4.3.1 切胶纯化PCR产物的技巧
PCR结束后,经常需要对产物进行纯化,以便移除非特异性扩增产物。切胶纯化是一种常见的PCR产物纯化方法:
1. **电泳分离:** 将PCR产物进行琼脂糖凝胶电泳,根据分子大小分离目的DNA片段。
2. **切取DNA条带:** 使用紫外灯下的观察和刀片切取含有目标DNA条带的部分凝胶。
3. **DNA的回收:** 利用凝胶回收试剂盒,按照制造商的说明将DNA从凝胶中回收。
### 4.3.2 非特异性扩增产物的去除技术
当PCR产物中包含非特异性扩增产物时,需要采用专门的技术进行去除:
1. **使用特殊的PCR净化试剂盒:** 一些试剂盒可以专门去除非特异性扩增产物,例如使用特殊的结合缓冲液来分离特异性扩增的DNA和非特异性产物。
2. **酶法切割:** 利用限制性内切酶选择性切割目标DNA片段,而忽略非特异性扩增产物。
3. **免疫亲和层析:** 利用针对PCR产物特异序列的抗体进行亲和层析,分离出目标DNA。
通过上述技术的合理应用,可以有效地减少非特异性扩增,提升PCR实验的准确性和可靠性。
# 5. 案例研究与问题解决
在本章中,我们将通过实际案例来分析如何设计并优化PCR反应,同时探讨在实验过程中可能遇到的问题及其解决方法。
## 5.1 成功案例分析:如何设计并优化PCR反应
### 5.1.1 临床样本的PCR条件优化案例
在进行临床样本的PCR实验时,准确和高效的DNA扩增是至关重要的。以下是一个设计并优化PCR反应的案例分析。
#### 实验步骤与优化过程:
1. **样本采集与前处理:** 对临床样本进行适当的前处理,例如使用血液/组织提取试剂盒提取DNA。
2. **引物设计:** 使用DNAman软件进行引物设计,确保高特异性与适宜的退火温度。
3. **PCR体系构建:** 设置基础反应体系,包含模板DNA、引物、dNTPs、缓冲液以及Taq聚合酶。
4. **温度梯度优化:** 使用DNAman软件模拟温度梯度实验,确定最佳退火温度。
5. **引物浓度与离子强度优化:** 在模拟实验指导下,调整引物浓度和优化反应体系的离子强度。
6. **PCR产物分析:** 进行PCR扩增后,通过琼脂糖凝胶电泳进行产物分析,确保特异性扩增。
#### 优化策略结果:
通过上述步骤,最终我们得到了清晰且特异性的PCR产物,可以进行后续的序列分析或基因分型。
### 5.1.2 环境样本的PCR条件优化案例
环境样本往往包含复杂的成分,因此PCR条件需要精细调整以获得可靠结果。
#### 实验步骤与优化过程:
1. **样本前处理:** 由于环境样本可能含有PCR抑制剂,需要进行适当的纯化处理。
2. **PCR体系选择:** 对于可能含有高GC含量的样本,选择耐热性能更强的聚合酶。
3. **温度优化:** 对退火温度进行优化,使用DNAman软件进行模拟实验。
4. **多重PCR条件优化:** 在多重PCR中,优化引物设计以减少引物间的相互作用。
5. **纯化与检测:** 对PCR产物进行纯化处理,并利用高分辨率电泳或芯片技术进行检测。
#### 优化策略结果:
经过一系列优化步骤,我们能够有效地扩增环境样本中的目标DNA片段,并且减少了非特异性扩增。
## 5.2 遇到的问题及解决方法
在进行PCR实验时,经常会遇到一些问题,本节将探讨这些问题并提供相应的解决方法。
### 5.2.1 非特异性扩增的常见问题及解决
#### 常见问题:
- 非特异性扩增条带
- 引物二聚体的形成
#### 解决方法:
1. **优化退火温度:** 在DNAman软件中进行温度梯度模拟实验,选择最优退火温度。
2. **调整引物浓度:** 在模拟实验后,适当调整引物浓度,减少引物间相互作用。
3. **使用添加剂:** 如BSA(牛血清白蛋白)可能有助于减少非特异性扩增。
4. **引物设计优化:** 在软件中重新设计引物,确保特异性。
### 5.2.2 弱信号或无产物的问题分析与对策
#### 常见问题:
- 扩增信号弱
- 缺乏扩增产物
#### 解决对策:
1. **检查模板DNA质量:** 确保模板DNA未被降解并且浓度适宜。
2. **优化酶浓度:** 按照DNAman软件模拟结果适当调整酶的用量。
3. **检查引物与模板的配对:** 确保引物与目标序列完全匹配。
4. **增加循环次数:** 如果初步实验中产物信号弱,可以适当增加循环次数。
通过这些案例分析和问题解决方法,我们能够更加深入地理解PCR实验过程中可能遇到的挑战,并掌握如何使用DNAman软件和实验技巧来克服这些困难。
0
0






